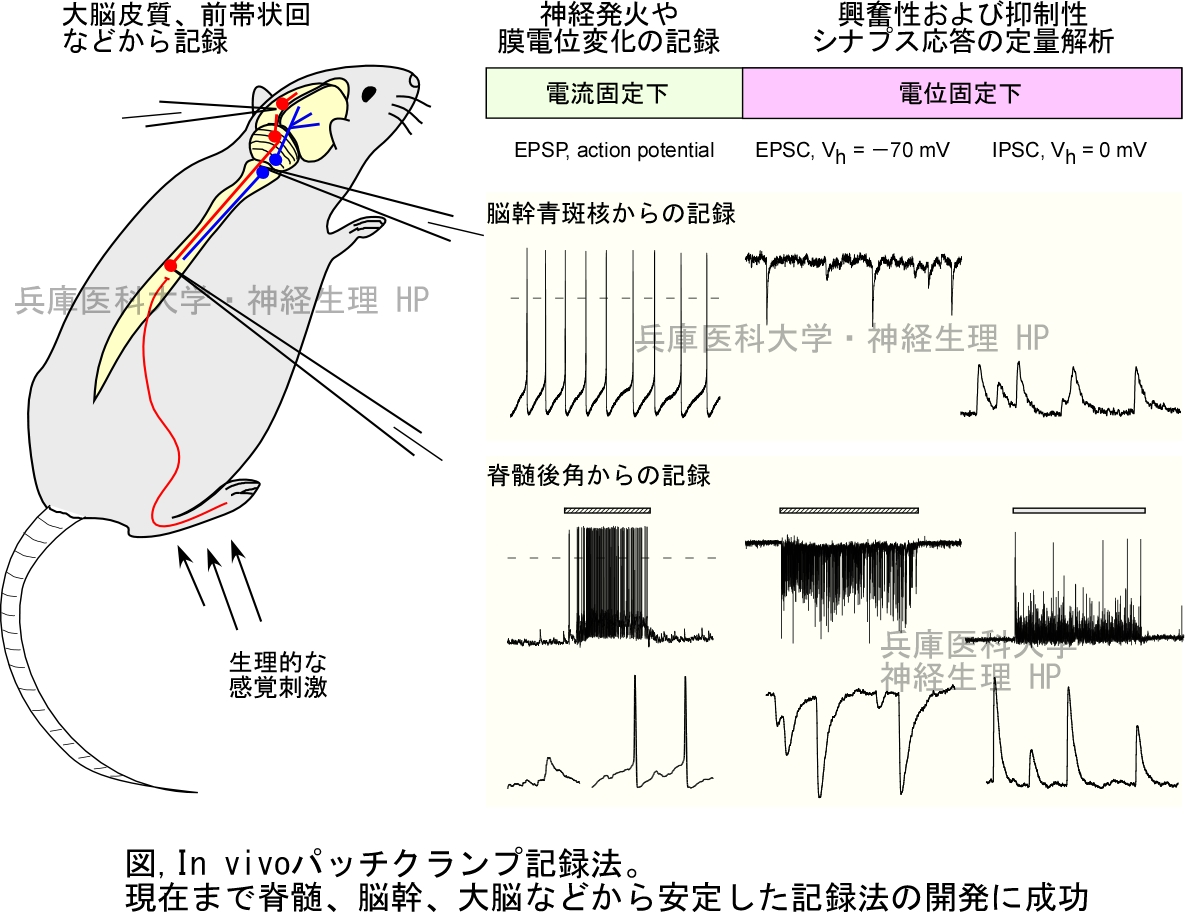
In vivoパッチクランプ法
In vivoパッチクランプ法は、病態モデルや遺伝子操作動物における行動異常の成因などを単一ニューロンやシナプスレベルで機能解析する上で極めて有用な手法です。行動解析と同様の生理的な刺激によって誘起されるシナプス応答を捉え、その振幅や発生頻度などの定量解析、全身や局所に投与する薬物の作用解析,光遺伝学などで神経核を賦活化した時の神経回路の挙動をリアルタイムで記録・解析ができます。特にブラインド法と呼ばれるパッチクランプ法は、記録細胞を視認する必要がないために高価な顕微鏡が不要であり設備投資が低く抑えられること、また、組織表面のみならず深部に位置する神経核やミエリンが発達し可視化が困難な成熟した動物、作製に日数を要するモデル動物を対象にできるなどの長所があります。以下の1-5に解説しています(詳細は1-5のタイトルをクリック)。

1. Furue H. In vivo patch-calmp recording technique. In: Patch Clamp Techniques: From Beginning to Advanced Protocols. (Springer
Protocols Handbooks), Springer-Verlag, pp.171-182, 2012
2. 古江秀昌.In vivo ブラインドパッチ法.In:最新パッチクランプ実験技術法 吉岡書店(岡田泰伸編) pp.115-120, 2011
3. Furue H, Katafuchi T, Yoshimura M. In vivo patch. In:Patch-Clamp Analysis: Advanced Technique, Second Edition (Eds. Wolfgang Walz) The Humana Press Inc pp.229-251,
2007
4. 古江秀昌、園畑素樹、吉村 恵.マウスおよびラット脊髄後角細胞からのin vivoパッチクランプ記録法. 日本生理学雑誌 65(10):315-321, 2003
5. Furue H, Narikawa K, Kumamoto E and Yoshimura M. Responsiveness of rat substantia gelatinosa neurons to mechanical but not
thermal stimuli revealed by in vivo patch-clamp recording. Journal of Physiology(London) 521:529-535, 1999
In vivoパッチクランプ法の開発
パッチクランプ法は従来から主に培養細胞や単離細胞およびスライス標本などに適用され、単一イオンチャネルの活動、シナプス伝達やその可塑性、神経回路の動作制御などの詳細かつ定量的な解析を可能とし、現在でも神経情報処理機構の解明に極めて有効な手法です。しかし、これらin
vitroの実験系では電気刺激や薬物投与によって誘起される応答を解析することが多いために、観察される応答や現象が如何なる生理的役割を果たしているのか説明することが困難でありました。この問題を補うために、1992年にin
vivoネコ大脳皮質からのパッチクランプ法が開発されました1。大脳皮質視覚野から視覚刺激によって誘起される神経応答を解析することが可能となって以来、in
vivoパッチクランプ法は視床、小脳、嗅球、大脳皮質聴覚野、バレル皮質などの体性感覚野および運動野など中枢神経系の様々な部位に適用された。しかしながら、これらの多くの研究は、微小電極のかわりにパッチ電極を利用して比較的安定して膜電位変化を記録するものが主であり、本来のパッチクランプ法の利点であるイオンチャネル電流やシナプス電流の定量的な解析には至りませんでした。その後、1999年に我々が脊髄後角細胞からのin
vivoパッチクランプ法を開発し、電位固定下に生理的感覚刺激によって誘起される興奮性シナプス後電流(Excitatory postsynaptic
current, EPSC)や抑制性シナプス後電流(Inhibitory postsynaptic current, IPSC)の記録・解析が可能となりました。現在では小脳や大脳皮質などにおいても電位固定下にシナプス電流の記録・解析が可能である。
このin vivoパッチクランプ法は成熟ラットあるいはマウスの脊髄後角細胞を記録の対象とし、電位固定下にシナプス電流の記録・解析を行うものです。脊髄後角、特に表層は痛みの中枢への入り口であり、痛みを伝える一次求心性線維、A線維やC線維の密な投射を受けます。皮膚へ生理的な痛みなどの感覚刺激を加えると、電位固定下にグルタミン酸を介したEPSC、あるいは抑制性介在ニューロン、GABAなどを介したIPSCが記録できます。また、我々が用いるブラインド法は記録電極の抵抗値を指標にパッチ電極を細胞に接近させ、ギガオーム・シールを形成する技術であり3、組織表面の細胞のみならず、深部の細胞にも適用でき、IR-DIC顕微鏡など高価な顕微鏡が不要です。In
vivo標本ではさらに、様々な神経核との連絡が保存されているために、記録部位に入力する神経核等を光遺伝学などで賦活化した時の影響を調べ、神経回路の生理的役割を明確にすることもできます。
1 Pei, X., Volgushev, M., Vidyasagar, T. R., and Creutzfeldt, O. D., Whole
cell recording and conductance measurements in cat visual cortex in-vivo.
Neuroreport 2 (8), 485 (1991).
2 Furue, H., Narikawa, K., Kumamoto, E., and Yoshimura, M., Responsiveness
of rat substantia gelatinosa neurones to mechanical but not thermal stimuli
revealed by in vivo patch-clamp recording. J Physiol 521 Pt 2, 529 (1999).
3 Yoshimura, M. and Nishi, S., Blind patch-clamp recordings from substantia
gelatinosa neurons in adult rat spinal cord slices: pharmacological properties
of synaptic currents. Neuroscience 53 (2), 519 (1993).