お知らせ
【卒業生の活躍】研究医コースでの幅広い学びが”かたち”に~将来は臨床と研究ができる医師をめざす
今年3月に医学部を卒業し、研究医コース学長賞を受賞した浅井 新喜さんが筆頭著者として投稿した論文が、2024年7月26日、国際誌「Molecular Neurobiology」に掲載されました。

浅井 新喜 さん
浅井さんは研究医コースの学生として4年間、生化学講座で藤原 範子 教授とともに研究を続けてきました。卒業試験と国家試験の間という多忙で精神的にも厳しい時期にもかかわらず、論文のリバイスに必要な実験を行う等、大変熱心に取り組んできました。
現在、浅井さんは藤田医科大学病院で研修医として日々励んでいます。将来は、筋萎縮性側索硬化症(ALS)をはじめとする神経変性疾患の基礎研究および臨床研究を行う臨床医 兼 研究者をめざしています。
そんな浅井さんに「研究医コース」での学びや今後の展望についてお話を伺いました。
※なお、本研究では浅井さんとともに関西学院大学 研究学生の矢埜 杏果さん、東野 智行さんが中心となって実験を行いました。
インタビュー
なぜ、研究医コースを選択されましたか?
入学した当初から研究に対する関心があり、1年生の夏休みに生化学講座で少し実験をさせてもらいました。2年生の基礎配属では、生化学講座の藤原先生とともにALSに関する研究を行い、非常に興味を持ちました。そのため、3年生以降の研究医コースでもALSの研究を続けたいと考え、生化学講座でお世話になることを決めました。
研究を進める中で学んだことや得たことがあれば教えてください。
細胞培養や遺伝子組換え実験に加え、研究のデザインの構築方法や考察の進め方、パワーポイントの作り方など幅広く学ばせていただきました。
研究や論文作成において大変だったことを教えてください。
研究を始めた当初は、試行錯誤の連続で、なかなか成果を得ることができず苦労しました。また、論文作成においては、6年生の秋以降に行ったリバイス用の追加実験が特に大変でした。
研究や臨床にかける想いを教えてください。
私が研究していたALSは、未だにそのメカニズムや治療法が確立されていない疾患です。ALSを含む神経変性疾患の原因を探求し、治療法を開発するためには基礎研究が不可欠であると考えています。現在、研修医として多様な疾患を臨床の観点から学んでおり、患者さんが直面している問題や症状を理解することが臨床において重要であると感じています。今後は、臨床での問題点や疑問を基礎研究に反映させ、基礎研究を進めていきたいと思っています。
今回、論文が掲載された率直な感想をお願いします。
素直に「うれしい」というのが感想です。この論文は藤原先生や生化学講座の先生方、関西学院大学の研究学生である矢埜さん、東野さんのお力添えをいただき、投稿することができました。心より感謝申し上げます。有難うございました。
今後どのようなキャリアを考えていますか?
将来的には脳神経内科医として、ALSをはじめとした神経変性疾患を診療できるようになりたいと考えています。ALSに関する治験が始まることもあり、ぜひ参加できたらうれしいです。最終的には、臨床と基礎研究の両方に携わる医師になりたいと願っています。
指導教員からのメッセージ(生化学 藤原 範子 教授)
浅井君、研究医コース学長賞および論文掲載おめでとうございます。浅井君は1年生の時から生化学講座で実験し、2年生の基礎配属実習も生化学講座だったので、6年間ずっと生化学講座に出入りしていました。浅井君は自主的に手際よく実験し、実験と実験の合間に自学自習し、成績は常にトップレベルでした。特に6年生11月以降のリバイス実験の時は、国家試験の勉強が大詰めなのに、細胞を培養したり、ウエスタンブロットをしたり・・・私の方が「大丈夫か・・・?」とハラハラドキドキしていました。今は研修医として修業の毎日だと思いますが、本研究を通じて培った「努力し続ける姿勢」は、医師になってからも必ず活きてくると思います。将来は臨床と基礎研究両方ができる「本当の研究医」として、さらなる活躍を期待しています。
研究医コースについて
兵庫医科大学では、医学部在学中に研究のおもしろさに触れて一定の素養を身につけることができるよう「研究医コース」を設置しています。「プレコース(第3学年次)」「専門コース(第4~6学年次)」の2コースがあり、それぞれ希望者から選考します。研究医コースの学生に対しては、研究活動に対する予算支援や希望する学生への奨学金の貸与も行っています。さらに、配属研究室の教員が学生のメンターとなり、マンツーマンで学習や進路の相談にも対応しています。
兵庫医科大学 研究医コース 公式ホームページ
論文掲載情報
論文タイトル
The Ile35 Residue of the ALS-Associated Mutant SOD1 Plays a Crucial Role in the Intracellular Aggregation of the Molecule
「ALS変異SOD1の35番目のイソロイシン残基は細胞内凝集に重要な役割を果たす」
掲載誌
Molecular Neurobiology(IF:4.6)
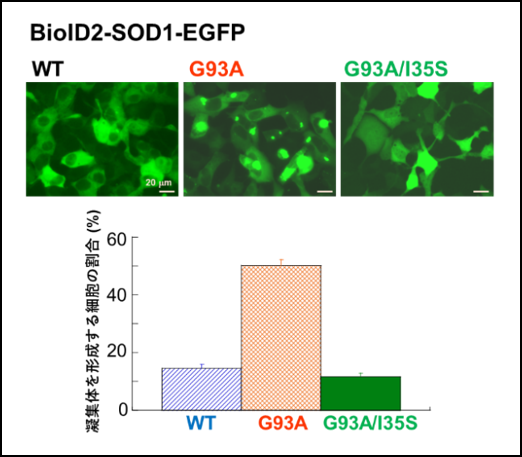
図1
本研究のポイント
・本研究では、BioID2をSOD1-EGFPのN末端側に融合した発現系を用いると、野生型SOD1よりALS変異SOD1で細胞内での凝集体形成が顕著に増大することを見出しました。
・この発現系を用いてSOD1のC末端側を順次欠失させたところ、SOD1のN末端側の部分配列である「1-34」よりも短いと凝集体が形成されませんでした。しかし、「1-35」よりも長いアミノ酸配列(1-120や1-140等の欠失変異)では凝集体を形成することを見出しました。
・ALS変異SOD1の35番目のアミノ酸残基であるイソロイシン(I35)を親水性のアミノ酸残基であるセリン(S)に置換すると、凝集体形成が著しく抑制されることを明らかにしました。
図1は野生型(WT)SOD1よりもALS変異SOD1であるG93A(93番目のアミノ酸がグリシンからアラニンに変異)で凝集体形成が増大すること、そしてI35をセリンに変異させたG93A/I35Sでは凝集体形成が抑制されることを示しています。