研究業績
ALS変異SOD1の35番目のイソロイシン残基が、細胞内凝集に重要な役割を果たすことを明らかに
今年3月に本学医学部を卒業し、研究医コース学長賞を受賞した浅井 新喜さんが筆頭著者として投稿した論文が、2024年7月26日、国際誌「Molecular Neurobiology」に掲載されました。浅井さんは研究医コースの学生として4年間、生化学講座で藤原 範子 教授とともに研究を続けてきました。本研究では、ALS変異SOD1の35番目のアミノ酸残基であるイソロイシン(I35)がSOD1の凝集体形成に重要な役割を果たしていることを明らかにしました。
研究の背景
筋萎縮性側索硬化症(ALS)を含む神経変性疾患では原因タンパク質の凝集やフォールディング異常が病態の原因と考えられています。Cu/Zn-スーパーオキシドディスムターゼ(SOD1)はスーパーオキシドを消去する抗酸化酵素ですが、SOD1遺伝子の変異は家族性の筋萎縮性側索硬化症(ALS)を引き起こすことが明らかになっています。SOD1は153個のアミノ酸から構成されるサブユニットを2つ有するダイマーとして機能しています。これまでに200個以上の点変異やC末端側が欠失したALS変異が見つかっています。このようなALS変異SOD1は野生型SOD1と比べて構造が不安定で凝集しやすいことが報告されており、ALS発症との関連が示唆されています。しかし、ALS発症機構は未だ解明されておらず有効な治療法も見つかっていないのが現状です。
そこで、私たちは細胞内におけるSOD1の凝集体形成機構の解明がALS発症機構の解明につながると考え、SOD1のC末端に緑色蛍光タンパク質(EGFP)を融合しHEK293細胞に発現させました。ところが、ALS変異SOD1でも凝集体はあまり形成されず、野生型SOD1との違いを見いだすことができていませんでした。
研究の成果
本研究では、BioID2をSOD1-EGFPのN末端側に融合した発現系を用いると、野生型SOD1よりALS変異SOD1で細胞内での凝集体形成が顕著に増大することを見出しました。この発現系を用いてSOD1のC末端側を順次欠失させたところ、SOD1のN末端側の部分配列である「1-34」よりも短いと凝集体が形成されず、「1-35」よりも長いアミノ酸配列(1-120や1-140等の欠失変異)では凝集体を形成することを見出しました。さらに、ALS変異SOD1の35番目のアミノ酸残基であるイソロイシン(I35)を親水性のアミノ酸残基であるセリン(S)に置換すると、凝集体形成が著しく抑制されました。
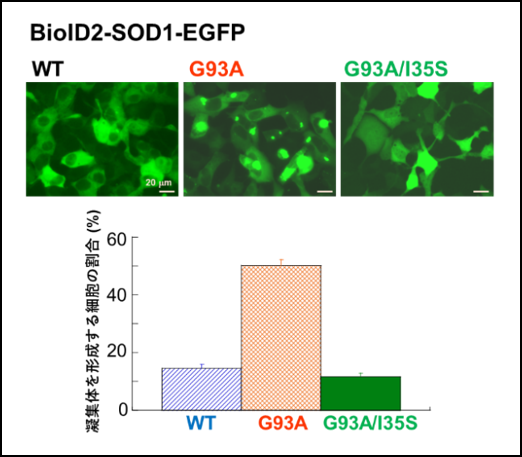
図1は野生型(WT)SOD1よりもALS変異SOD1であるG93A(93番目のアミノ酸がグリシンからアラニンに変異)で凝集体形成が増大すること、そしてI35をセリンに変異させたG93A/I35Sでは凝集体形成が抑制されることを示しています。
以上の結果から、SOD1の35番目のアミノ酸残基であるイソロイシン(I35)が凝集体形成に重要な役割を果たしていることが明らかになりました。
今後の課題と展望
これまでI35に変異をもつ家族性ALS患者は未だ報告されていません。つまり、孤発性ALSを含め全てのALS患者が有するSOD1には凝集体形成に重要なI35が存在していることになります。今後はI35を介するSOD1の凝集体形成がALS発症に関与するのかALSモデル動物で確認していく必要があると考えています。凝集体形成がALS発症に直接関与することが明らかになれば、I35を新たなターゲットとする薬剤開発の道が開ける可能性があると期待しています。
掲載情報
掲載誌
Molecular Neurobiology(IMPACT FACTOR : 4.6)
論文タイトル
The Ile35 Residue of the ALS-Associated Mutant SOD1 Plays a Crucial Role in the Intracellular Aggregation of the Molecule
「ALS変異SOD1の35番目のイソロイシン残基は細胞内凝集に重要な役割を果たす」
論文著者名
浅井 新喜*1、矢埜 杏果*1、東野 智行*1、吉原 大作*1,、崎山 晴彦*1,、江口 裕伸*1
福島 和明*2、鈴木 敬一郎*1,、藤原 範子*1
*1 兵庫医科大学・医学部・生化学講座
*2 兵庫医科大学・医学部・化学講座
研究費の出処
研究医コース研究支援費(浅井 新喜)
科研費基盤C(22K11870 代表: 藤原 範子)
公益財団法人 日本応用酵素協会 酵素研究助成(藤原 範子)
文部科学省科学技術人材育成費補助事業「ダイバーシティ研究環境実現イニシアティブ(特性対応型)」(兵庫医科大学 2023年度 英語論文投稿支援)(藤原 範子)