学校法人 兵庫医科大学
新規低分子化合物ががん増殖に係るタンパク質を分解・除去するメカニズムを解明
2017.4.25
兵庫医療大学薬学部の田中明人教授、馬渕美雪研究員らの研究グループは、エーザイ株式会社(以下、エーザイ)との共同研究により、新しい低分子化合物が、がん増殖に係る特定のタンパク質を分解・除去するメカニズムを解明しました。
日本人の死因1位である“がん”の治療法に「抗がん剤治療」があることは一般的に知られています。この抗がん剤の一種で、がん細胞の増殖・転移に係る分子を標的にして阻害する「低分子医薬品」の多くは、病気の原因となるタンパク質(以下、原因タンパク質)に直接結合し、その機能を阻害することで薬理作用を発揮します。しかしながら、低分子医薬品ではその阻害が難しい原因タンパク質も多いため、生体内の原因タンパク質の量自体を減らす治療の開発が試みられています。遺伝子治療はその代表的な方法の一つですが、不安定なDNAやRNAを細胞内に届ける技術は、いまだ本格的な実用化に至っていません。
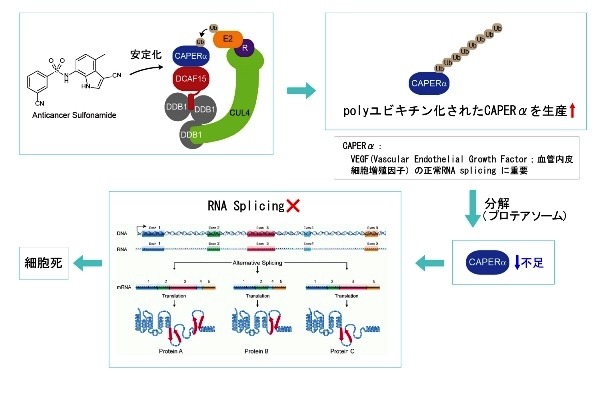
このたび、兵庫医療大学とエーザイの研究グループは、エーザイが創出した生体内で安定かつ経口投与可能な新規低分子化合物が、がん増殖に係る特定のタンパク質を分解し、その量を減らすという新規メカニズムを有することを発見しました。すなわち、この低分子化合物は、生体内で不要となったタンパク質を分解除去するシステム(ユビキチン/プロテアソーム系)を利用して、がん細胞増殖およびがん周辺環境の維持に重要なタンパク質CAPERαを分解除去し、抗がん作用を発揮することが新たに解明されました。
本研究成果は2017年4月25日(英国現地時間24日16:00)に、国際学術雑誌「Nature Chemical Biology」電子版に掲載されました。
米・Stanford大学 James K. Chen教授からのコメント
「従来法では、疾病の原因となるタンパク質が同定されても、無数にある体内の細胞から副作用なく取り除く方法は限られていた。今回発見された分解を促進するという新メカニズム発見は新たな医薬品創製法のヒントになる」
論文情報
| 掲載誌 | 「Nature Chemical Biology」online 24th,April,2017 |
| 論文タイトル | 「Selective degradation of splicing factor CAPERα by anticancer sulfonamides」 |
| 著者 | Taisuke Uehara, Yukinori Minoshima, Koji Sagane, Naoko Hata Sugi, Kaoru Ogawa Mitsuhashi,Noboru Yamamoto, Hiroshi Kamiyama, Kentaro Takahashi, Yoshihiko Kotake, Mai Uesugi, Akira Yokoi, Atsushi Inoue, Taku Yoshida, Miyuki Mabuchi, Akito Tanaka & Takashi Owa |
本研究成果に関する論文は、日本時間4月25日(現地時間24日)に、国際科学雑誌「Nature Chemical Biology」の電子版に掲載されました。
本研究に関するお問い合わせ先
学校法人兵庫医科大学 総務部 広報課
〒663-8501 兵庫県西宮市武庫川町1番1号
TEL:0798-45-6655
FAX:0798-45-6219
E-mail:kouhou●hyo-med.ac.jp(●はアットマーク)
URL:http://www.corp.hyo-med.ac.jp/
研究概要
スルホンアミド抗がん剤は、 スプライシングファクター:CAPERαを選択的に分解誘導する
近年、細胞におけるタンパク質の分解機構が、重要ながんの治療標的として注目されている。プロテアソーム阻害剤であるBortezomibは、多発性骨髄腫の治療薬として顕著な治療効果を発揮している。さらに、同じく多発性骨髄腫治療薬であるLenalidomideはE3ユビキチンリガーゼ複合体の基質認識タンパク質であるCereblon(セレブロン)と結合して、転写因子IKZF1およびIKZF3を分解誘導することが報告されている。
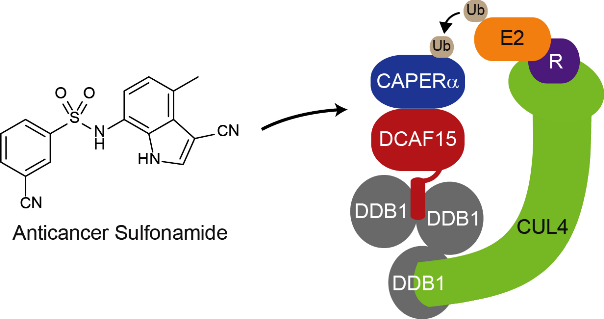
エーザイが抗がん剤として開発をおこなってきたスルホンアミド抗がん剤(E7820およびE7070(Indisulam))は、長らくその標的分子及び作用機序が不明であったが、今回、これら抗がん剤がE3ユビキチンリガーゼ複合体の基質認識タンパク質であるDCAF15と結合し、スプライシングファクターの一つであるCAPERαを選択的に分解誘導することで抗腫瘍効果を発揮することが明らかとなった。この新規作用機序は、DCAF15遺伝子のノックアウトおよび、アミノ酸残基置換を伴うCAPERαの遺伝子編集が、細胞に薬剤耐性をもたらすことによって確認されている。Lenalidomideの作用機序の発見に続くこの新たな知見は、E3ユビキチンリガーゼを介した選択的なタンパク質分解誘導作用が、これまでUndruggable(薬剤の標的にならない)と考えられていた分子を狙い撃ちすることができる、新たな創薬戦略として有望であることを示している。
参考図
体内の不用タンパク質分解機構:ユビキチン・プロテアソームシステム