好塩基球とアレルギー
生体内の免疫応答はTh1細胞とTh2細胞が産生するサイトカインによって調節されます。Th1細胞は細胞性免疫を誘導し、Th2細胞は液性免疫・アレルギーを誘導します。どちらの細胞もナイーブCD4+T細胞から分化し、分化誘導には次の3つのシグナルが必要です。
- 抗原提示細胞(antigen presenting cells:APC)が取り込んだ抗原が分解されてできたペプチドがMHCクラスII分子に提示され、これをT細胞レセプター(TCR)が認識します。
- APCが発現するCD80、CD86とT細胞が発現するCD28の刺激補助分子によってT細胞が活性化します。
- Th1細胞分化にはIL-12、Th2細胞分化にはIL-4というように、至適なサイトカインが必要です。
私たちは、白血球細胞の1つである好塩基球がTh2細胞の誘導と増強に重要な役割を演じていることを明らかにしました。さらに、好塩基球はアレルギー性鼻炎と食物アレルギーの発症にも重要な細胞であることがわかってきました。
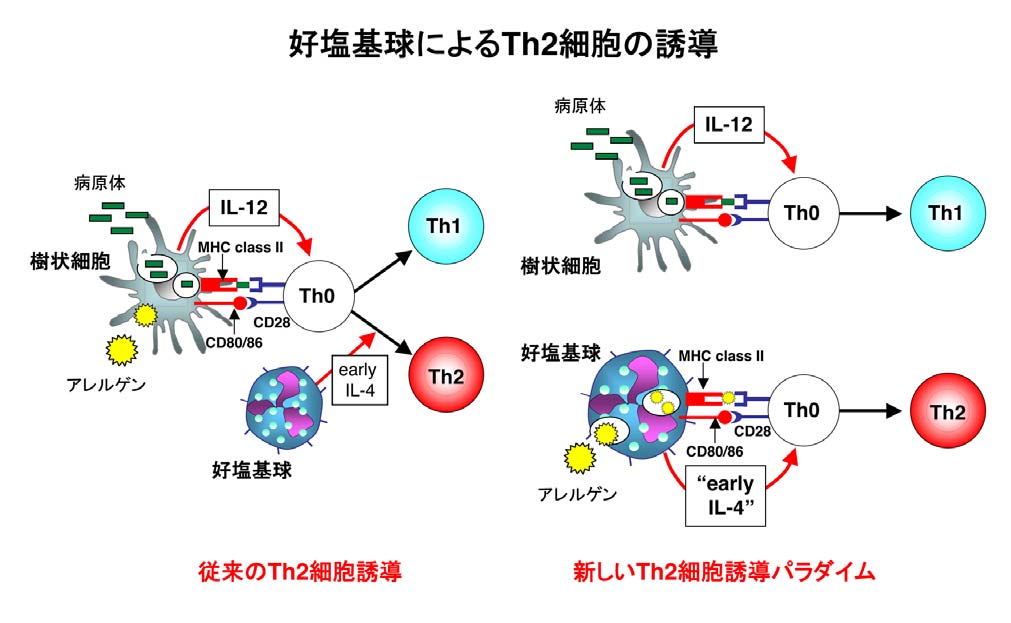
好塩基球によるTh2細胞の誘導
好塩基球はマスト細胞と同様IgE抗体を介したアレルギー性炎症における重要なエフェクター細胞です。好塩基球は末梢血白血球の1%未満で通常の組織に存在しませんが、アトピー患者ではアレルゲンが侵入する炎症局所に多くの好塩基球が集積します。さらに、好塩基球はアレルギー疾患の重要なエフェクター細胞として近年クローズアップされています。
一方、好塩基球はIL-18/IL-33やプロテアーゼ活性を持つアレルゲンに反応して著明にIL-4を産生することから、"early IL-4"の産生細胞として、Th2細胞の誘導に関わる機能的な細胞ではないかと考えられました。
2009年私たちを含め3つのグループは、好塩基球はアレルギーのエフェクター細胞に留まらず、アレルゲン—IgEの複合体、プロテアーゼ活性を有するアレルゲンまたは蠕虫由来のアレルゲンに反応して、"early IL-4"を産生すると同時に、細胞表面にMHCクラスIIとCD80/CD86などの刺激補助分子を発現し、アレルゲンをプロセッシングして抗原提示細胞としてナイーブCD4+T細胞に抗原の情報を提供する結果、特異的にTh2細胞を誘導することを明らかに、Nature Immunologyに発表しました(Nat Immunol, 2009)。
本研究は、Paul Ehrlichが好塩基球を発見してから130年目の全く新しい機能の発見としてNature Immunologyの表紙を飾り、世界的に極めて高い評価を得ています。
(2009年5月24日付けの朝日新聞、毎日新聞などに研究内容の記事が掲載されました)
好塩基球によるTh2細胞の増強
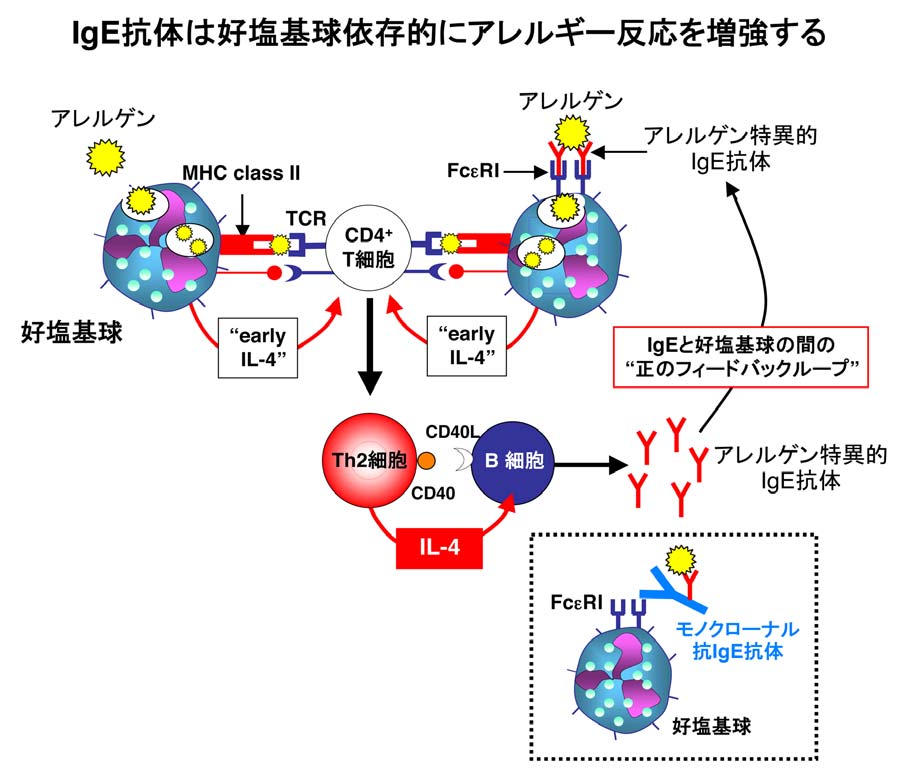
アレルギー疾患の中には、しばしばアレルギー反応が増悪する症例を経験します。私たちは、このアレルギー増悪のメカニズムの1つとして、Th2細胞によって産生されたIgEがアレルゲンと架橋し、IgE受容体(FcεRI)を介して好塩基球がアレルゲンを効率よく取り込むことで更にTh2細胞を誘導し、IgE産生/アレルギー反応を増強するという、IgEと好塩基球の間の"正のフィードバックループ"が存在するのではないかと考えています。
実際、抗原—IgE複合体を生体内投与すると、好塩基球依存的にTh2細胞を効率よく誘導し、アレルギー反応を増強します。
近年本邦では、モノクローナル抗IgE抗体(omalizumab)がステロイドに抵抗性を示す重症喘息患者に新しい抗アレルギー薬として採用されています。モノクローナル抗IgE抗体は、好塩基球とマスト細胞上のFcεRIとIgEとの結合に競合してアレルゲンとの架橋を阻害する結果、好塩基球とマスト細胞からのサイトカインや化学伝達物質の産生を抑制すると考えられています。
私たちはこれに加え、モノクローナル抗IgE抗体はIgEと好塩基球の間の"正のフィードバックループ"をブロックすることで、新たなTh2細胞の誘導/アレルギーの増悪を抑制する効果があるのではないかと考えています。