アレルギー性鼻炎の研究
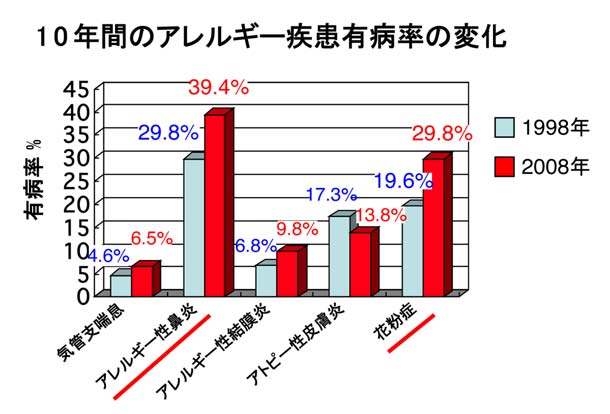
アレルギー性鼻炎は「くしゃみ、水性鼻漏、鼻閉」を3主徴とするI型アレルギー疾患の代表です。患者数は先進国を中心に増加の一途にあり、世界中で推定6億人を超えます。わが国においても、国民の39.4%がアレルギー性鼻炎に罹患しています。
アレルギー性鼻炎はハウスダストなどをアレルゲンとする通年性アレルギー性鼻炎と、花粉症の季節性アレルギー性鼻炎に二分されます。欧米における花粉症の原因アレルゲンの約50%はブタクサ花粉ですが、日本では原因アレルゲンの大半がスギとヒノキです。わが国ではこの10年間に、通年性アレルギー性鼻炎の有病率が18.7%から23.7%に増加したのに対し、花粉症は19.6%から29.8%と著しく増加しています。他のアレルギー疾患と比較すると、如何に多くの国民がアレルギー性鼻炎に悩まされているか理解できると思います。
花粉症の病態は、花粉曝露直後のくしゃみを伴ったIgE抗体依存性の「即時相」と、6時間以後の鼻粘膜への著明な好酸球浸潤を特徴としたTh2サイトカイン依存性の「遅発相」で構成されます。同じ気道アレルギー疾患である喘息に関する研究は広く行なわれ、その発症機序は飛躍的に解明されてきました。
一方、アレルギー性鼻炎の発症機序は未だ不明な点が多く、根本的な治療法は確立していません。その最大の理由として、喘息はその病態を非常に良く反影したモデルマウスが作製され、様々な遺伝子欠損マウスを用いて解析されているのに対し、花粉特異的アレルギー性鼻炎モデルマウスは未だ確立していないことが挙げられます。
私たちは、福井大学医学部と京都府立医科大学の耳鼻咽喉科学教室と共同でアレルギー性鼻炎患者の血清や鼻粘膜を解析しています。さらに、ブタクサ花粉やスギ花粉に特異的なアレルギー性鼻炎モデルマウスを樹立しました。これら臨床検体とマウス実験から、アレルギー性鼻炎の発症メカニズムを解明すると共に、新しい診断・治療技術の開発を研究しています。
アレルギー性鼻炎患者とIL-33
私たちは理化学研究所ゲノム医科学研究センターとの共同研究で、日本人のスギ特異的アレルギー性鼻炎患者(170名)と健常人(100名)の血清IL-33値と遺伝子多型について解析しました。その結果、正常コントロールの血清IL-33値が361pg/mlに対し、アレルギー性鼻炎患者の平均値は549pg/mlと有意に高値を示しました。
更に、一塩基多型(single nucleotide polymorphism :SNP)を用いた症例対照相関解析の結果、イントロン3のSNP (rs1929992)にIL-33とアレルギー性鼻炎の発症とに有意な相関を認める調節遺伝子を発見しました(Clin Exp Allergy, 2008)。
さらに、福井大学医学部耳鼻咽喉科との共同研究で、同意の得られた外来受診患者から吸入アレルゲン特異的IgE測定と花粉症症状の有無をアンケート調査し分類した、(1)スギ花粉症発症患者(スギ特異的IgE陽性、スギ花粉飛散時期に花粉症あり)13名と、(2)コントロール(吸入抗原7項目全てに対して特異的IgE陰性、花粉症なし)11名を対象に、2009年度スギ飛散時期に鼻上皮細胞を擦過して鼻粘膜からRNAを抽出し、IL-33mRNA発現を解析しました。その結果、スギ花粉症発症患者の鼻粘膜ではIL-33mRNA発現が著明に亢進していることを明らかにしました(J Allergy Clin Immunol, 2012)。
以上の結果から、花粉飛散時期には患者鼻粘膜のIL-33mRNA発現が亢進し、IL-33蛋白が鼻腔内に放出されると考えられました。
アレルギー性鼻炎とIL-33/好塩基球
上記の研究結果を基盤に、私たちは全く新しい花粉特異的アレルギー性鼻炎モデルマウスを作製し、その発症におけるIL-33の病因的役割を検討しました。
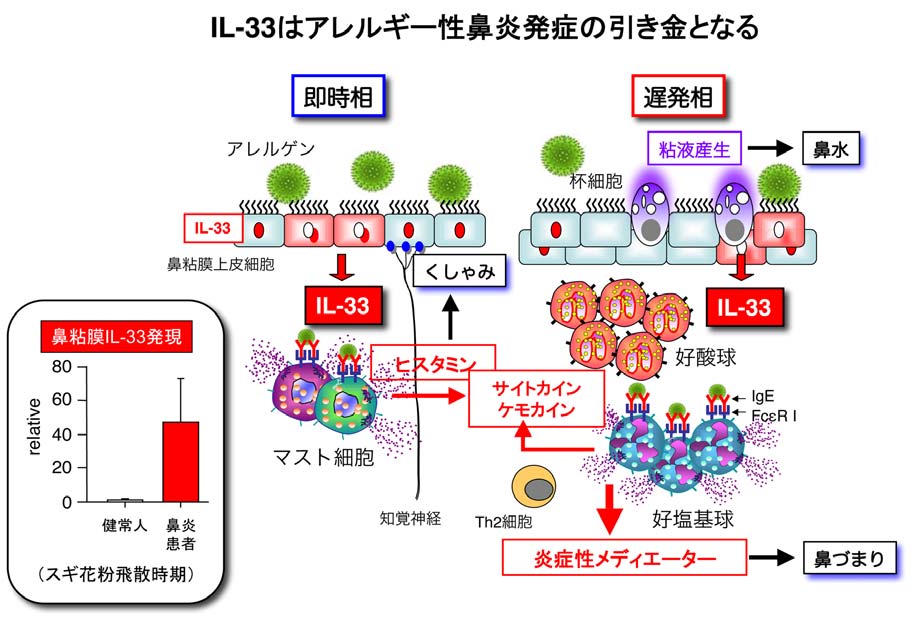
Balb/cマウスにブタクサ花粉 (ragweed pollen; RW)と水酸化アルミニウムを用いて免疫し、14日目から4日間RW又はPBSを点鼻投与した結果、次の様なRW特異的アレルギー性鼻炎モデルマウスを樹立すると共に、その発症機序を解明しました(J Allergy Clin Immunol, 2012)。(図)
- RW点鼻群はPBS点鼻群に比較して、点鼻後10分間のくしゃみ回数の亢進、24時間後の鼻粘膜への好酸球浸潤、鼻粘膜上皮の多列化とムチン産生の亢進を伴い、血清RW特異的IgE及び頸部リンパ節細胞からのTh2サイトカイン産生を著明に増強するヒトのアレルギー性鼻炎に類似したモデルマウスを樹立しました。更に、
- 元来鼻粘膜に存在しない好塩基球がRW点鼻後経時的に著明に浸潤増加することを発見しました。一方、
- IL-33欠損マウスとFcεRI欠損マウスではくしゃみ回数と好酸球/好塩基球浸潤が著明に抑制されました。次に、
- マウス鼻粘膜上皮細胞核内にIL-33は局在し、RWによって点鼻後30分と短時間に細胞外にIL-33は放出されることを発見しました。
- 正常マウスにRWを点鼻後経時的に鼻洗浄液を採取し、IL-33産生をEISAで測定した結果、点鼻後2時間をピークに迅速にIL-33産生が検出されました。
以上の結果から、RWによって誘導される内因性IL-33はFcεRI+細胞(好塩基球とマスト細胞)を刺激してくしゃみ、好酸球/好塩基球の遊走に関与することが示唆されました。実際、 - アレルゲンとIgE抗体でFcεRIが架橋され、活性化したマスト細胞はIL-33濃度依存的にヒスタミン産生を増強しました。更に、
- 好塩基球とマスト細胞はFcεRIの架橋とIL-33で刺激されるとIL-13、eotaxin、RANTES(好酸球遊走因子)とMCP-1、MIP-1α(好塩基球遊走因子)産生が著明に誘導されました。
本研究から、アレルギー性鼻炎(花粉症)の発症に花粉刺激による鼻粘膜上皮細胞から産生される IL-33と好塩基球が必須の因子 であることを発見しました。私たちのモデルマウスは、アレルギー性鼻炎の発症機序の解明に有用であるだけでなく、発症機序を基盤としたイノベーティブなアレルギー性鼻炎治療・予防技術開発への応用に非常に重要なモデルマウスだと考えています。
(2012年4月5日付けの朝日新聞、読売新聞、日本経済新聞、産經新聞、神戸新聞などに記事が掲載され、テレビニュースで研究内容が紹介されました)
局所性アレルギー性鼻炎
アレルギー性鼻炎は抗原特異的血清IgE値の上昇を伴うアトピー型アレルギー性鼻炎と、伴わない非アレルギー性鼻炎に分けられます。近年、非アレルギー性鼻炎患者の中にも血清IgE値は検出されませんが、鼻粘膜局所でIgE抗体を検出できるアレルギー性鼻炎(local allergic rhinitis: LAR)が存在することが報告されています。しかし、わが国ではLARに対する明確な位置づけも、正式な呼び名もありません。ここでは、LARを「局所性アレルギー性鼻炎」と呼ぶことにします。スペインでの調査では、成人の鼻炎患者のうちアトピー型アレルギー性鼻炎63%、非アレルギー性鼻炎11%に対し、局所性アレルギー性鼻炎は26%と報告されています。わが国では、アレルギー性鼻炎自覚症状者は約5,500万人で、毎年新たに約420万人が鼻炎症状を発症するとの報告があります(平成23年1月、アサヒ飲料株式会社:花粉症意識・対策実態調査)。これら多くの自覚症状者の中にはアトピー素因のない人がある年突然鼻炎症状を発症する人も含まれていると考えられます。
局所性アレルギー性鼻炎はアトピー型アレルギー性鼻炎と同様、アレルゲンに曝露すると鼻炎症状(くしゃみ、水性鼻漏、鼻閉)と鼻粘膜への好酸球浸潤が認められます。さらに、局所性アレルギー性鼻炎患者はその後アトピー型アレルギー性鼻炎となり、喘息などを合併することも知られています。そのため早期の診断と治療が重要です。しかし、局所性アレルギー性鼻炎の病態と発症機序については不明な点が多く、鼻粘膜局所のIgE抗体検出以外に有効な診断法もありません。
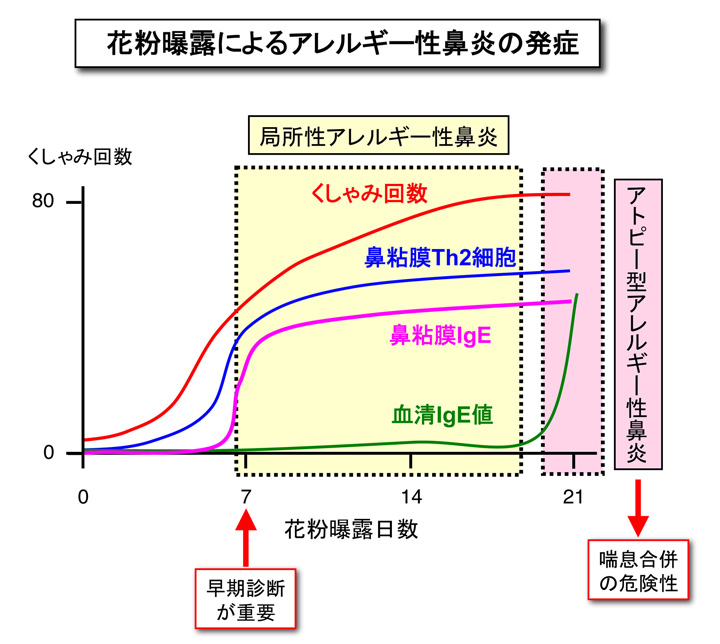
私たちは、正常BALB/cマウス(アトピー素因を持たないマウス)にブタクサ花粉 (ragweed pollen: RW)を連日点鼻することで、次の様な局所性アレルギー性鼻炎モデルマウスを作製すると共に、その発症機序を解明しました(PLOS ONE, 2014)。(図)
- 正常マウスに7日間毎日RWを点鼻すると、点鼻後10分間のくしゃみ回数が日と共に増加し、鼻粘膜への好酸球浸潤と鼻粘膜局所でのIgE産生が認められました。一方、血清中の抗原特異的IgE値は検出感度以下でした。以上の結果は、ヒトの局所性アレルギー性鼻炎の病態をよく反影しています。さらに、
- 点鼻3日目と極めて早い段階で、鼻粘膜にはRW抗原に反応してTh2サイトカイン(IL-4,IL-5,IL-13)を産生するCD4+Th2細胞が集積し、RW点鼻を継続すると経時的にTh2細胞からのTh2サイトカイン産生量は増大しました。特に、
- 鼻粘膜に浸潤するCD4+T細胞はRW刺激がなくても、IL-2と共にIL-33で刺激すると極めて大量のIL-5とIL-13を産生しました(IL-33刺激ではIL-4の産生が認められないのも特徴です)。一方、
- 正常マウスに3週間毎日RWを点鼻すると、くしゃみ回数は日と共にさらに増加し、鼻粘膜への好酸球浸潤、鼻粘膜上皮の多列化と粘液産生の亢進を伴い、頸部リンパ節細胞からのTh2サイトカイン産生と共に、血清中に抗原特異的IgEが著明に増加するアトピー型アレルギー性鼻炎に進行しました。しかし、
- 3週間連続点鼻マウスでもRW点鼻開始後6日目からRW点鼻と共にステロイド剤を点鼻すると、アレルギー性鼻炎患者と同様くしゃみ回数の増加は完全に抑制されました。しかし、抗原特異的血清IgEは抑制されません。一方、
- 3週間連続点鼻マウスの肺にRWを吸入させると、気道への著明な好酸球浸潤と粘液産生細胞(杯細胞)の過形成を伴った喘息様症状を発症しました。即ち、局所性アレルギー性鼻炎はアトピー型アレルギー性鼻炎と喘息を発症する危険因子となりうることが明らかになりました。次に、
- 局所性アレルギー性鼻炎の発症機序を検討する目的で、IgE受容体欠損マウスにRWを3週間連続点鼻しました。その結果、くしゃみ回数の増加は抑制されましたが、鼻粘膜への好酸球浸潤には何ら影響されませんでした。一方、
- T細胞とB細胞を欠損するRag2欠損マウスにRWを連続点鼻すると、くしゃみ回数の増加と好酸球浸潤は共に著明に抑制されました。
本研究から、1)アトピー素因を持たないマウスでも経鼻的にアレルゲンに感作されると鼻粘膜局所にのみIgEが検出され鼻炎症状を発症すること、2)さらにアレルゲンへの曝露が持続するとアトピー型アレルギー性鼻炎に進行し、喘息を合併することが明らかになりました。これは局所性アレルギー性鼻炎患者の病態とその後の臨床経過に極めて似ています。
さらに本研究から、局所性アレルギー性鼻炎モデルマウスの特徴として、まず初めに鼻粘膜局所にTh2細胞の集積を認め、Th2細胞が病態形成(くしゃみ、好酸球浸潤)に中心的な役割を果たすことも確認されました。
また,局所性アレルギー性鼻炎の治療としてステロイド点鼻薬は症状(くしゃみ)の抑制には有効でしたが、根本的なアレルギー状態(Th2細胞、IgE産生)の改善には何ら影響しないことが判明しました。この結果は、局所性アレルギー性鼻炎患者に対する対症療法だけでは不十分であり、早期診断によりアレルゲンへの曝露を回避することがアトピー型アレルギー性鼻炎への進行と他のアトピー疾患への合併を予防するのに重要であることを意味しています。
以上の結果から、私たちは局所性アレルギー性鼻炎の早期診断法や治療法の確立には鼻粘膜のCD4+T細胞を標的としたアプローチが重要と考えています。この早期診断法として、患者鼻粘膜から採取したCD4+T細胞からのIL-33刺激によるTh2サイトカイン(IL-5,IL-13)産生の測定は、検査室レベルで実施可能で且つ精度の高い診断法となる可能性を備えています。
私たちのモデルマウスは、局所性アレルギー性鼻炎の発症機序の解明に有用であるだけでなく、発症機序を基盤としたイノベーティブな診断法と治療・予防技術開発への応用に非常に重要なモデルマウスだと考えています。
(2014年8月21日付けの産経新聞、神戸新聞などに研究内容の記事が掲載されました)
ディーゼル排気微粒子(PM2.5)とアレルギー性鼻炎
従来からのアレルゲンに加え、大気汚染の原因物質とされている浮遊粒子状物質で、直径が2.5μm以下の微粒子状物質(Particulate Matter, PM; PM2.5)のアレルギー性鼻炎への影響が社会的に問題視されています。この環境微粒因子は、工場での燃焼による煤塵などからなりますが、ディーゼル排気微粒子(ディーゼルエンジンの排気ガスに含まれる微粒子)がPM2.5の大部分を占めます。
本邦では近年、中国大陸から高濃度のPM2.5が飛来した時期と春のスギ花粉飛散時期が一致し、以前に比較してアレルギー性鼻炎患者数は急激に増加し、症状の悪化を訴える患者が増加しました。さらに、国内の自動車からのディーゼル排気微粒子が原因で、今日も喘息やアレルギー性鼻炎患者はその症状の悪化に悩まされています。
しかし、ディーゼル排気微粒子(PM2.5)のアレルギー性鼻炎を悪化させるメカニズムは不明であり、それに対する治療・予防方法は全く確立されていません。この様な背景から、ディーゼル排気微粒子(PM2.5)によるアレルギー性鼻炎増悪メカニズムを明らかにし、その影響の評価法と治療・予防薬のスクリーニング法を開発することが急がれます。
私たちはヒトアレルギー性鼻炎の病態に類似した花粉特異的アレルギー性鼻炎モデルマウス(J Allergy Clin Immunol, 2012)を用いて、ディーゼル排気微粒子が鼻粘膜上皮細胞のバリア機能(タイトジャンクション:隣り合う上皮細胞を強く結合する膜蛋白質)を破壊することでアレルギー性鼻炎を悪化させることを明らかにしました。さらに、それを予防する薬剤と薬剤のスクリーニング法を開発しました(Clin & Exp Allergy, 2015)。
尚、ディーゼル排気微粒子は国立環境衛生研究所でディーゼルエンジンを燃焼し、排気ガスから精製調節した微粒子状物質(直径0.4μmのPM2.5)を使用しました。
- 正常マウスにブタクサ花粉と水酸化アルミニウムをday0に、ブタクサ花粉のみをday7に腹腔内投与し免疫した後、day14から4日間ブタクサ花粉(1.0mg/20μL/回)又はリン酸緩衝液(PBS:20μL/回)を点鼻投与しすると、ブタクサ花粉点鼻群はPBS点鼻群に比較して、点鼻後10分間のくしゃみ回数の亢進、24時間後の鼻粘膜への好酸球浸潤、鼻粘膜上皮の多列化とムチン産生の亢進を伴い、血清ブタクサ花粉特異的IgE抗体及び頸部リンパ節細胞からのTh2サイトカイン産生を著明に増強するヒトのアレルギー性鼻炎に類似したモデルマウスを作製できます(J Allergy Clin Immunol, 2012)。
- この鼻炎モデルマウスでは、上記の1/10量のブタクサ花粉(0.1mg/20μL/回)点鼻ではくしゃみ回数を増強しません。しかし、ブタクサ花粉とディーゼル排気微粒子(10μg/20μL/回)を4日間同時点鼻すると、点鼻後2日目からくしゃみ回数は著明に上昇しました。
- ブタクサ花粉とディーゼル排気微粒子は同時に飛散するとは限りません。そこで、ブタクサ花粉で免疫したマウスにディーゼル排気微粒子を4日間点鼻した後にブタクサ花粉を点鼻しました。その結果、ブタクサ花粉の点鼻初日から著しくしゃみ回数が増加しました。一方、
- ディーゼル排気微粒子をブタクサ花粉と同時点鼻しても、Th2免疫応答(鼻粘膜に浸潤する好酸球数、血清IgE値と頸部リンパ節細胞からのTh2サイトカイン産生)には影響しませんでした。そこで、
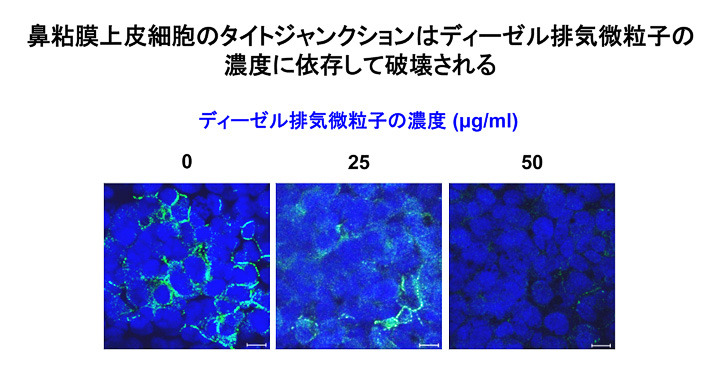
- ディーゼル排気微粒子の鼻粘膜上皮細胞に対する影響を検討する目的で、ヒト鼻粘膜上皮細胞株にディーゼル排気微粒子(0~50μg/ml)を添加・培養し、24時間後の1)上皮細胞間接着構造(タイトジャンクション)蛋白質の免疫染色、2)細胞膜の電気抵抗と3)FITC標識したデキストランの上皮細胞透過性を測定しました。その結果、タイトジャンクションはディーゼル排気微粒子濃度依存的に破壊され(図1)、細胞膜の電気抵抗は著明に低下し、FITC標識したデキストランの上皮細胞透過性は著しく亢進していました。さらに、
- ディーゼル排気微粒子を4日間単独点鼻したアレルギー性鼻炎モデルマウスでは鼻粘膜上皮細胞のタイトジャンクションは完全に破壊されていました。一方。ブタクサ花粉点鼻はタイトジャンクションに何ら影響しませんでした。次に、
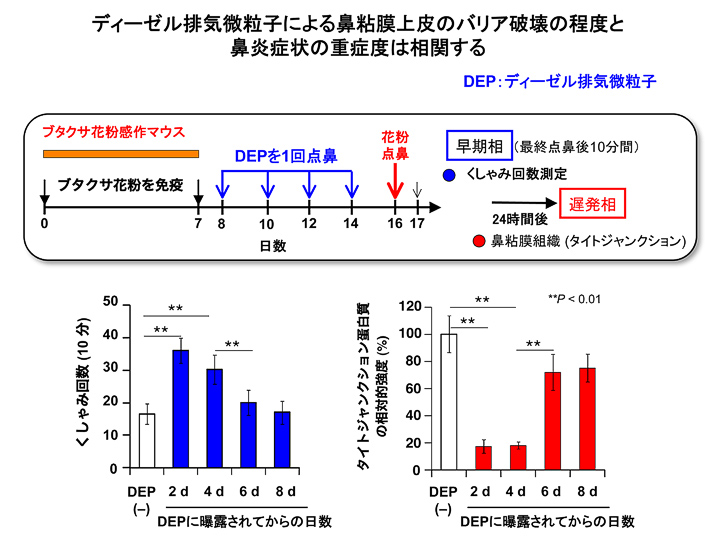
- ディーゼル排気微粒子によるタイトジャンクションの破壊の程度と鼻炎症状(くしゃみ回数)が相関するかを検討する目的で、ブタクサ花粉で免疫したマウスにday8, day10, day12とday14にディーゼル排気微粒子を1回点鼻し、day16にブタクサ花粉を点鼻しました。その結果、ディーゼル排気微粒子を点鼻してから2日目と4日目(day12とday14)にブタクサ花粉を点鼻したマウスのみ、くしゃみ回数は著明に上昇しました。これに相関して、ディーゼル排気微粒子点鼻後4日目までは鼻粘膜上皮細胞のタイトジャンクションは著しく破壊されていましたが、6日目には修復傾向が認められ、8日目には完全に元に修復していました(図2)。即ち、ディーゼル排気微粒子による鼻粘膜のバリア破壊の程度と鼻炎症状の重症度は相関しました。最後に、
- ディーゼル排気微粒子による鼻粘膜のバリア破壊を予防する薬剤を検討しました。従来から、ディーゼル排気微粒子はその構成成分による酸化ストレスを介して気道上皮細胞のバリア機能を低下させることが知られています。そこで、ヒト鼻粘膜上皮細胞株にディーゼル排気微粒子と同時に抗酸化剤N-アセチルシステイン(体内の抗酸化物質であるグルタチオンの前駆物質であるアミノ酸)を添加しました。その結果、N-アセチルシステイン添加群ではタイトジャンクションは保護され、FITC標識したデキストランの上皮細胞透過性は抑制されました。さらに、
- ブタクサ花粉で免疫したマウスにブタクサ花粉を点鼻する2日前にディーゼル排気微粒子と同時にN-アセチルシステインを点鼻して前処置すると、マウス鼻粘膜上皮細胞のタイトジャンクションは完全に保護され、花粉を点鼻してもくしゃみ回数の増加は全く認められませんでした。
以上、本研究から次の3つの成果が得られました。
-
ディーゼル排気微粒子による鼻粘膜上皮細胞のバリア機能の破壊によって花粉アレルゲンの上皮細胞への透過性が亢進する結果、それ単独ではくしゃみ症状を発症しない少量の花粉でも鼻炎症状を重症化させる可能性があることが明らかになりました。
-
おそらくディーゼル排気微粒子に含まれる炭化水素成分、有機物質や硫化塩などによる酸化ストレスによって鼻粘膜上皮細胞のタイトジャンクションは破壊され、抗酸化剤N-アセチルシステインはその作用を完全に予防できることが明らかになりました。
- 本アレルギー性鼻炎モデルマウス(in vivo)または、上皮細胞株(in vitro)を用いることでディーゼル排気微粒子に対する鼻粘膜上皮タイトジャンクションの破壊を指標として、これを抑制する新規アレルギー性鼻炎治療・予防薬のスクリーニング法を確立することが可能となりました。
ディーゼル排気微粒子(PM2.5)による健康被害はアレルギー性鼻炎に留まらず呼吸器疾患(喘息や慢性閉塞性肺疾患など)、皮膚疾患(アトピー性皮膚炎など)、神経疾患や循環器疾患など多岐にわたることが知られています。そのため、上記スクリーニング法によって明らかにされるディーゼル排気微粒子に対する治療・予防薬は、これら疾患に対しても効果が期待されます。
(2015年8月6日付けの毎日新聞、読売新聞、神戸新聞などに記事が掲載され、テレビニュースで研究内容が紹介されました)