
当科では神経科学分野の基礎から臨床にわたる幅広い分野で研究を行っております。 その一部ではありますが、紹介させていただきます。 |
| 項目 | 研究代表者 |
| 筋強直性ジストロフィー中枢神経症状の病態解明 パーキンソン病、非典型パーキンソニズムに対する拡散テンソル解析、VBMを用いた脳画像解析 |
木村 卓 |
高齢者てんかんと認知症の関連性についての検討 |
武田 正中 |
| 神経軸索ジストロフィーの病因に関する研究 |
渡邊 将平 |
| 筋強直性ジストロフィー中枢神経症状の病態解明 木村卓、西将光、吉積一樹 |
|
筋強直性ジストロフィーは成人で最も頻度の高い筋ジストロフィー症です。筋力低下、筋強直症などの骨格筋症状のほか、日中過眠や記銘力低下などの中枢神経症状を伴います。これらの中枢神経症状は筋力が比較的保たれている病期よりみられ、健康関連QOLに大きくかかわっています。本疾患での中枢神経病態を解明し、治療へ結びつけるための研究を行っています。 |
|
|
筋強直性ジストロフィー症はMyotonin-protein kinase遺伝子(DMPK)の非翻訳領域に存在するCTGリピートの異常伸長が原因です。 CTGリピートから転写されたCUG伸長部分でヘアピン構造を形成する事により、DMPK-RNAの細胞質への搬出が妨害されて核内に蓄積します。 CUG伸長部分に結合するスプライシング制御蛋白(muscleblindファミリーのMBNL1/2など)も共に核内に閉じ込めてしまうため、種々の遺伝子のスプライシング異常を引き起こします(図1)。 私たちは本症患者筋で多数のスプライシング異常を報告してきました。 筋肉でのスプライシング異常および症状の多くは、MBNL1ノックアウトマウス筋でも再現されるため、筋肉ではMBNL1が核内に閉じ込められ、本来のスプライシング制御機能を発揮できないことが病態につながると考えられています。 一方MBNL1ノックアウトマウスでは中枢神経症状やスプライシング異常は再現できないのに対して、MBNL2ノックアウトマウスでは再現できることを報告しました。 さらにMBNL1/MBNL2ダブルノックアウトマウスでより重篤な症状・スプライシング異常が再現できることも報告しています。 これらのことから脳では主にMBNL2の搬出障害が種々のスプライシング異常を引き起こしており、MBNL1も相補的にスプライシング異常に関与していると考えられます。 |
|
参考文献
| 1. | Suenaga K, Lee KY, Nakamori M, Tatsumi Y, Takahashi MP, Fujimura H, Jinnai K, Yoshikawa H, Du H, Ares M Jr, Swanson MS, Kimura T.・Muscleblind-like 1 knockout mice reveal novel splicing defects in the myotonic dystrophy brain.・PLoS One・7・e33218・2012 |
| 2. | Charizanis K, Lee KY, Batra R, Goodwin M, Zhang C, Yuan Y, Shiue L, Cline M, Scotti MM, Xia G, Kumar A, Ashizawa T, Clark HB, Kimura T, Takahashi MP, Fujimura H, Jinnai K, Yoshikawa H, Gomes-Pereira M, Gourdon G, Sakai N, Nishino S, Foster TC, Ares M Jr, Darnell RB, Swanson MS. Muscleblind-like 2-mediated alternative splicing in the developing brain and dysregulation in myotonic dystrophy. Neuron・75・437~450・2012 |
| 3. | Goodwin M, Mohan A, Batra R, Lee KY, Charizanis K, Fernández Gómez FJ, Eddarkaoui S, Sergeant N, Buée L, Kimura T, Clark HB, Dalton J, Takamura K, Weyn-Vanhentenryck SM, Zhang C, Reid T, Ranum LP, Day JW, Swanson MS. ・MBNL Sequestration by Toxic RNAs and RNA Misprocessing in the Myotonic Dystrophy Brain.・Cell Rep.・12・1159~1168・2015 |
| 4. | Freyermuth F, Rau F, Kokunai Y, Linke T, Sellier C, Nakamori M, Kino Y, Arandel L, Jollet A, Thibault C, Philipps M, Vicaire S, Jost B, Udd B, Day JW, Duboc D, Wahbi K, Matsumura T, Fujimura H, Mochizuki H, Deryckere F, Kimura T, Nukina N, Ishiura S, Lacroix V, Campan-Fournier A, Navratil V, Chautard E, Auboeuf D, Horie M, Imoto K, Lee KY, Swanson MS, de Munain AL, Inada S, Itoh H, Nakazawa K, Ashihara T, Wang E, Zimmer T, Furling D, Takahashi MP, Charlet-Berguerand N.・Splicing misregulation of SCN5A contributes to cardiac-conduction delay and heart arrhythmia in myotonic dystrophy. ・Nat Commun.・7・11067・2016 |
| 5. | Furuta M, Kimura T, Nakamori M, Matsumura T, Fujimura H, Jinnai K, Takahashi MP, Mochizuki H, Yoshikawa H. ・Macroscopic and microscopic diversity of missplicing in the central nervous system of patients with myotonic dystrophy type 1.・Neuroreport・29・235~240・2018 |
| 6. | Takashi Kimura・Molecular Defects in the DM Central Nervous System in Myotonic Dystrophy・Myotonic Dystrophy: Disease Mechanism, Current Management and Therapeutic Development (Masanori P. Takahashi and Tsuyoshi Matsumura Editors)・115-132・Springer・2018 |
| 7. | Nishi M, Kimura T, Igeta M, Furuta M, Suenaga K, Matsumura T, Fujimura H, Jinnai K, Yoshikawa H. Differences in splicing defects between the grey and white matter in myotonic dystrophy type 1 patients. PLoS One. 2020 May 14;15(5):e0224912, 2020 |
| パーキンソン病、非典型パーキンソニズムに対する拡散テンソル解析、VBMを用いた脳画像解析 木村卓、笠間周平、坂本峻 |
|
パーキンソン病関連疾患は、パーキンソン病・痴呆を伴うパーキンソン病・びまん性レビー小体病・多系統萎縮症・進行性核上性麻痺•大脳皮質基底核症候群など多くの病気を含みますが、病初期の診断は容易ではありません。 |
| 高齢者てんかんと認知症の関連性についての検討 武田 正中 |
|
当教室および認知症疾患医療センターにおいて「アミロイドPETを利用した早期認知症診断」の研究のため、神経学的評価、高次脳機能評価、MRI、SPECTとアミロイドPETとの関連を検討しています。これと同時に高齢者てんかんとの関連を検討したいと考えています。 |
|
||||
| 神経軸索ジストロフィーの病因に関する研究 渡邊 将平 |
| 神経軸索ジストロフィー(Neuronal Axonal Dystrophy: NAD)は、神経軸索内に異常ミトコンドリア、小胞体、ニューロフィラメント、dense
body等の細胞小器官(オルガネラ)が異常集積する病態です。 NADが主要な病変として出現する疾患としてはNBIA(Neurodegeneration with brain iron accumulation)や乳児型神経軸索ジストロフィーなどがありますが、その詳細な病因は未解明です。 そこで、我々はNADのモデル動物であるgad (gracile axonal dystrophy)マウス(国立精神医療研究センター・神経研究所の和田圭司先生から供与)を用いてNADの病態解明に挑むことにしました。このgadマウスはUbiquitin carboxy-terminal hydrolase L1(UCH-L1)遺伝子が欠損しており、延髄薄束核部分に特異的な病理像がみられます。 UCH-L1遺伝子の欠損によって、タンパク質の品質管理に重要なユビキチン・プロテアソーム系(ユビキチンを介したタンパク質分解システム:以下UPS)におけるポリユビキチン化が阻害されることが先行研究で報告されています。 我々はUPSと並んでタンパク質品質管理に重要なオートファジー系に着目し、実験を行いました。その結果、gadマウスではcontrolマウス(対照としての正常マウス)と比べて、延髄薄束核でLAMP1, LC3, p62などのオートファジー関連タンパクの発現が増加していることを見出しました。(図1) |
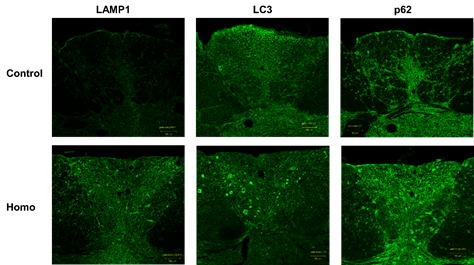 図1)gad マウスの延髄薄束核の免疫染色像。 Controlマウスに比べてhomo(gad mouse)でLAMP1、LC3、p62の発現量が増加している。 |
| さらにgadマウスの延髄薄束核を電子顕微鏡で観察したところ、NADでみられるdense body(矢尻)に加え、二重膜をもったオートファゴソーム様の構造物(矢印)も見出しました。(図2) |
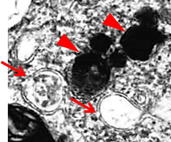 |
| 図2)gad mouseのhomoの延髄薄束核の電顕像。 電子密度の高いdense body(矢尻)とオートファゴソーム様の構造物(矢印)がみられる。 |
| 以上の結果から、gadマウスの病態にオートファジー系が関与している可能性が示唆されました。 今後はオートファジーの各段階についてさらに検討をすすめていきたいと考えています。 この研究を進めることにより、オートファジーの関与が知られている他の神経変性疾患(アルツハイマー病やパーキンソン病など)の病態解明につながることが期待されます。 |
| Copyright(c) 2011 Department of Internal Medicine, Division of Neurology Hyogo College Of Medicine. All Rights Reserved. |