術後腸管癒着モデルマウス
現在の高度な医療技術を駆使しても、消化器外科手術の実に60%以上に術後腸管癒着が発生し、腸管-腸管、腸管-腹膜などの癒着形成は再手術を困難にするばかりではなく、腸閉塞、腹痛、不妊症などの合併症を高頻度に惹き起こし、臨床的に問題となっています。しかし、術後腸管癒着に対する予防法、予防薬は未だ確立されていません。
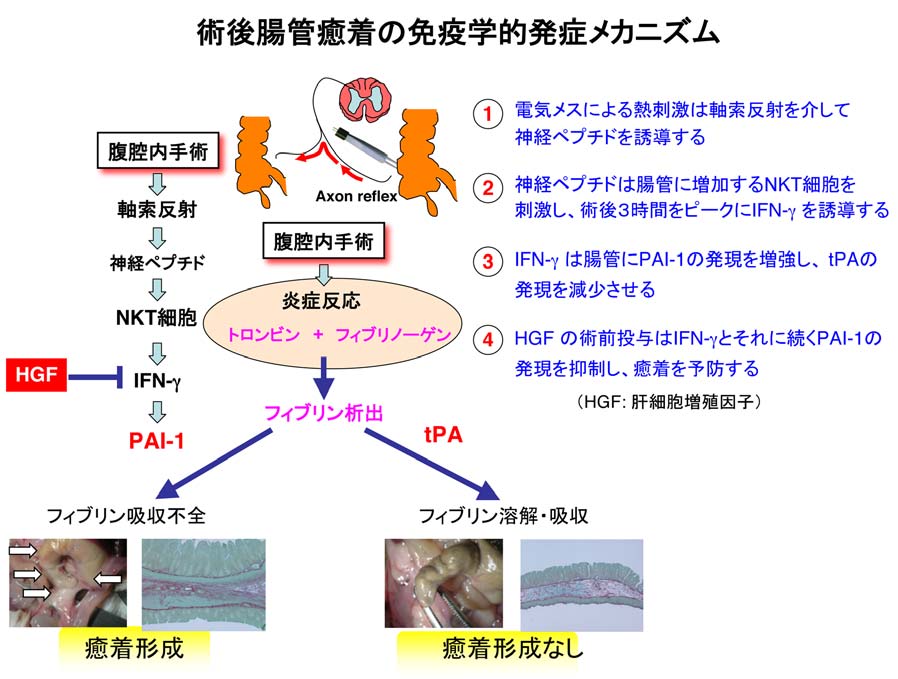
従来、術後腸管癒着形成に関わる因子として血液凝固系との関連が提唱されていました。すなわち、手術に伴う炎症によってフィブリンが腸管壁に析出します。手術侵襲が軽度の場合、これを溶かすプラスミノーゲン活性化因子[tissue plasminogen activator (tPA)]が働き、フィブリンは溶解して腸管壁は正常に修復します。しかし、手術に伴う炎症が強い場合、プラスミノーゲンに対する抑制因子[plasminogen activator inhibitor 1 (PAI-1)]が活性化されて、フィブリンが蓄積し、線維化がおこり癒着を形成します。
2002年ハーバード大学のグループから、腸管癒着形成にTh1細胞が関与することが報告され、癒着形成に免疫学的要因が新たに関与することが提唱されました。しかし、その分子生物学的メカニズムの解析と、癒着を制御する治療技術に関する研究は皆無でした。その理由の1つとして、人の消化器外科手術に伴う腸管癒着と同等なモデルマウスが確立されていなかったことが挙げられます。
私たちは、手術類似侵襲としてマウスの5 mm腹部切開創より、実際に人の手術に使用するバイポーラ電気メスを用いて盲腸の腸管膜反対側を1秒間焼灼し、閉腹することで、1週間後に強度の腸管癒着を形成するマウスモデルを確立し、その発症機序を解析しました。その結果、手術侵襲による軸索反射を介して腸管に誘導された神経ペプチドの1つタヒキニンが、同じく手術侵襲によって腸管に集積したNKT細胞を刺激して術後3時間をピークにIFN-γ産生を誘導し、このNKT細胞由来IFN-γが凝固系を促進するPAI-1の発現を増強し、逆に線溶系を促進するtPAを抑制する結果、 癒着形成を促進することを明らかにしました。更に私たちは、抗IFN-γ抗体あるいは肝細胞増殖因子(HGF)蛋白を術前1日前又は術直後に1回皮下投与すると、PAI-1の誘導を抑制し術後腸管癒着の発症を完全に予防できることを発見しました。
私たちが明らかにした術後腸管癒着の発症機序が様々な腹腔内手術に普遍的に適応し、且つマウス同様、大型動物に対してもHGFが癒着予防薬として有効であることが明らかになれば、HGF蛋白は全ての腹腔内手術(胃切、肝切、帝王切開など)に伴う術後癒着形成を抑制する薬剤として直ちに臨床応用され、術後癒着による弊害に苦しむ多くの患者さんへの福音となるものと確信しています。
尚、本研究はその臨床的意義が極めて高いことから2008年4月のNature Medicineに掲載され(Nat Med, 2008)、国内外から大きな反響を得ました。
(2008年3月18日付けの朝日新聞など全国紙5紙に記事が掲載され、NHKテレビニュースで研究内容が紹介されました)