研究業績
~世界初の治験!クローン病や急性GVHDに対する新たな細胞治療~ 「羊膜間葉系幹細胞の治験製品提供と医師主導治験」を開始

輸血・細胞治療学 准教授 山原 研一
兵庫医科大学病院、および北海道大学病院は、「羊膜間葉系幹細胞(以下、羊膜MSC)によるクローン病および急性移植片対宿主病(GVHD)に対する第I/II相医師主導治験」について、クローン病は2017年9月、急性GVHDは同年11月にそれぞれ厚生労働大臣へ治験届を提出しました。
急性GVHD(※1)やクローン病(※2)といった難治性疾患には、副腎皮質ステロイド剤や免疫抑制剤といった炎症・免疫を抑える薬が治療に用いられますが、すべての方に必ずしも有効ではありません。一方、MSCにも免疫を調整する作用があり、我が国では骨髄MSCが急性GVHDに対する再生医療等製品として既に実用化されています。兵庫医科大学病院および北海道大学病院の研究グループでは、骨髄MSCよりも、(1)幹細胞数が多く、(2)増殖能も高く、(3)採取に侵襲性のない「羊膜MSC」を用いた細胞治療研究を進めており、この度、世界で初めて「羊膜MSC」の治験薬製剤化に成功し、急性GVHDやクローン病に対する医師主導治験を開始するに至りました。
今後、兵庫医科大学が羊膜MSCの治験製品(治験製品名:AM01)を提供し、兵庫医科大学病院・北海道大学病院を実施医療機関とした急性GVHD・クローン病に対する第I/II相医師主導治験を進め、再生医療等製品として早期の製造販売承認取得を目指します。
本治験のポイント
世界初
・世界初の羊膜MSCの治験薬製剤化
・対象が難治性疾患であり期待性が高い
安全性の向上
・拒絶反応が少ない
・ドナー安全性確認が確実
・羊膜採取に侵襲性なし
期待される有効性
・動物モデルで治療の有効性を証明済み
・T細胞の分化・増殖を強力に抑制することで、治療効果が期待
強力な開発体制
・兵庫医科大学病院・北海道大学病院による共同医師主導治験
・兵庫医科大学臨床研究支援センター・北海道大学病院臨床研究開発センターによる強力な開発支援
低コスト化
・妊婦の羊膜(医療廃棄物)を利用
・幹細胞数が多く、大量培養が容易
本研究の背景
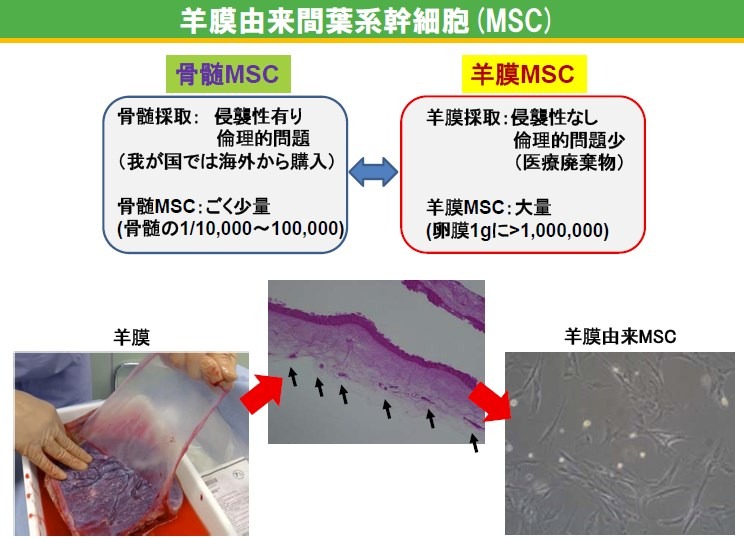
MSCは細胞治療の有望な候補細胞として注目され、近年MSCを用いた臨床研究が国内外で数多く行われ、その免疫抑制作用が脚光を浴びています。我が国においても、骨髄MSCが急性GVHDに対する再生医療等製品として承認を受け、製造販売されています。
しかしながら、骨髄MSCは(1)骨髄採取に侵襲性がある、(2)骨髄中の存在頻度が0.001~0.01%と非常に低く、治療に必要な細胞数を得るには長期間培養が必要であり高コスト、といった問題があります。
一方、兵庫医科大学病院および北海道大学病院の研究グループは、これまでに羊膜MSCに関する前臨床研究を進め、羊膜MSCが骨髄MSCと同様、多分化能および免疫抑制能を持つことを明らかにしてきました、骨髄MSCにはない羊膜MSCの特徴として、(1)医療廃棄物がソースである、(2)含有するMSCが非常に多い、(3)免疫抑制能が高い、といった利点が挙げられ、これは即ち(1)低コスト、(2)短期間、(3)少ない投与量、にてMSCを用いた細胞治療が実用化可能であることを示しています。
本研究グループは、AMEDのサポートのもと、骨髄MSCと比較し、(1)低コストで、(2)倫理的問題が少なく、(3)安全性が向上し、(4)製造が容易な、羊膜MSCの製剤化に成功し、急性GVHDおよびクローン病に対する治療応用を目的に、この度、第I/II相医師主導治験の計画を厚生労働大臣に届けました。
今年度から開始のこれら医師主導治験は2019年度終了予定です。数年の次相の治験を経て、条件付早期承認制度を利用し、再生医療等製品として早期製造販売承認取得を目指します。
対象疾患
※1 急性移植片対宿主病(GVHD)
白血病、悪性リンパ腫、多発性骨髄腫等の血液悪性疾患の治療法の一つである「造血幹細胞移植」後の早期にみられる皮疹・黄疸・下痢を特徴とする重篤な副作用。ドナー(提供者)由来の移植片の、宿主(提供を受ける人)に対する免疫反応と定義されます。
日本では現在年間5,000例以上の造血幹細胞移植が行われていますが、そのうち半数以上が軽症も含めて急性GVHDを発症しています。
※2 クローン病
口腔から肛門までの消化管に炎症を起こして、びらんや潰瘍を形成する病気で、特に小腸や大腸に好発します。クローン病は、原因が不明であるため根治療法は存在しておらず、慢性的に良くなったり悪くなったりを繰り返すため、継続的な治療が必要です。
日本では、40,000例を超える患者さんがおられます。
羊膜MSCについて
MSC(間葉系幹細胞)を用いた細胞治療は、MSCが有する免疫抑制効果を利用しています。我々は、これまでに数多くの研究により、羊膜MSCが急性GVHDやクローン病の動物モデルにおいて、治療効果を発揮することを証明しており、臨床の場においてもその治療効果が期待されます。
一方、MSCの中でも、先行する再生医療等製品として骨髄MSCがありますが、骨髄採取に侵襲性を伴う他、コスト面・品質面(提供者の完全なウイルス感染否定が難しい、長期培養になりやすい、等)での課題があります。一方、羊膜はご協力頂ける帝王切開予定の妊婦さんから、通常の処置で得られる胎盤から分離しますので、余計な侵襲性は全くありません。また、出産後一定の期間の後に改めてウイルス否定試験を実施することで、羊膜のウイルス感染を完全に否定し、安全性が向上しています。1つの羊膜から数百~数千万個のMSCが得られますので、短期間に大量のMSCを得ることが出来ます。 更に、高性能・安全・高品質・国産の細胞培養用添加剤であるウシ血清「NeoSERAⓇ」を使用し、大量・安全・高品質な羊膜MSCの治験製品製造を目指しています。「NeoSERAⓇ」は、厚生労働省所管の独立行政法人 医薬品医療機器総合機構(PMDA)から、「再生医療等製品材料適格性確認書」を取得し、再生医療用途としての承認を得ています。
治験の実施体制
今回の羊膜MSC治験製品AM01を用いた急性GVHD・クローン病に対する治験は、兵庫医科大学がAM01を提供し、兵庫医科大学病院・北海道大学病院双方が実施医療機関として関係診療科が参加して行う、二施設共同医師主導治験です。いずれの治験実施に関しても、北海道大学病院臨床研究開発センターが治験調整事務局として、また、兵庫医科大学臨床研究支援センターが全面的にサポートを行い、実施されます。
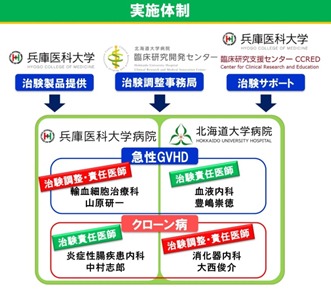
【急性GVHD】
・治験調整・責任医師・治験製品提供者
兵庫医科大学病院
輸血細胞治療科 准教授 山原 研一
・治験責任医師
北海道大学病院
血液内科 教授 豊嶋 崇徳
【クローン病】
・治験調整・責任医師
北海道大学病院
消化器内科 准教授 大西 俊介
・治験責任医師
兵庫医科大学病院
炎症性腸疾患内科 教授 中村 志郎
・治験製品提供者
兵庫医科大学病院
輸血細胞治療科 准教授 山原 研一
治験の概要および参加方法
急性GVHD
造血幹細胞移植を受け、既存の治療である副腎皮質ステロイド剤に治療抵抗性の急性GVHD患者に対して、AM01の静脈内投与を行い、その安全性評価を主たる評価とし、有効性を副次評価することを目的とします(UMIN試験ID:UMIN000029945)。 投与方法ですが、AM01を下記の投与量に従って、0日目、7日目、14日目、21日目に点滴で静脈内投与します。
低用量群 1.0×10⁶ 個 /kg (0、7、14、21日目)
高用量群 4.0×10⁶ 個 /kg (0、7、14、21日目)
用量は低用量群から開始し、少なくとも3例の低用量群での安全性に関し、独立した組織である効果安全性評価委員会にて確認された後に高用量群へ移行し、高用量群での安全性を確認します。
クローン病
既存の治療で効果が不十分の、中等症の活動期クローン病患者を対象として、AM01を静脈内投与し、その安全性および有効性を評価することを目的とします(UMIN試験ID:UMIN000029841)。
投与方法ですが、AM01を下記の投与量に従って、0日目、7日目に点滴で静脈内投与します。
低用量群 1.0×10⁶ 個 /kg (0、7日目)
高用量群 4.0×10⁶ 個 /kg (0、7日目)
用量は低用量群から開始し、少なくとも3例の低用量群での安全性に関し、独立した組織である効果安全性評価委員会にて確認された後に高用量群へ移行し、高用量群での安全性を確認します。
備考
医師主導治験
製薬企業ではなく、医師自らが、計画立案から実施・報告等の業務および運営のすべてを行う治験(医薬品医療機器等法上の承認を得るために行われる臨床試験)のことです。
第I/II相試験
第I相試験は、安全性(有害事象、副作用)について検討することを主な目的とした探索的試験であり、第II相試験は第I相の結果をうけて、比較的軽度な少数例の患者を対象に、有効性・安全性・薬物動態などの検討を行う試験である。今回の治験では、安全性を重きに置きつつ、有効性も同時に評価しますので、第I/II相試験としています。
本研究関連の助成について
・国立研究開発法人 日本医療研究開発機構 橋渡し研究戦略的推進プログラム(2017~19年度(予定))
・国立研究開発法人 日本医療研究開発機構 再生医療実用化研究事業(2016~18年度(予定))
・国立研究開発法人 日本医療研究開発機構 橋渡し研究加速ネットワークプログラム(2014~16年度)
・厚生労働省 厚生労働科学研究費補助金(2011~13年度)